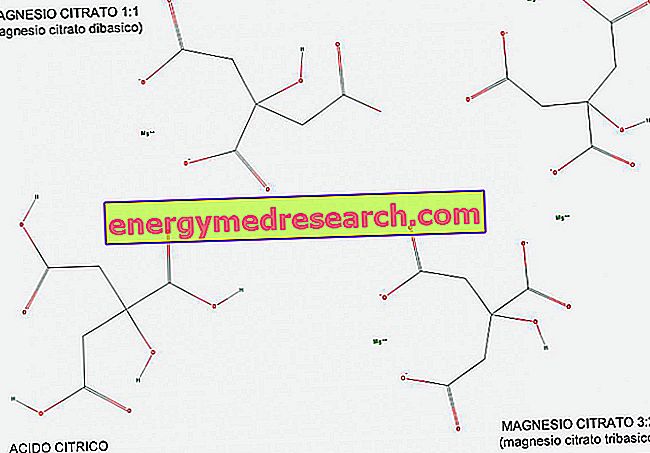
Eine tribasische (oder triprotische) Säure ist eine Säure, die drei Wasserstoffionen aufweist, die in einer Säure-Base-Reaktion abgegeben werden. Anhand der Abbildung können wir sehen, wie Zitronensäure ein Beispiel für tribasische Säure ist, da sie drei COOH-Carboxylgruppen aufweist, die Wasserstoff H leicht übertragen können.
Magnesiumcitrat liegt sowohl im Verhältnis 1: 1 (1 Magnesiummolekül pro Citratmolekül) als auch im Verhältnis 3: 2 (3 Magnesiummoleküle pro 2 Citratmoleküle) vor.
Magnesiumcitrat 1: 1 wird zweibasisch genannt, weil es ein zweibasisches Salz der Zitronensäure ist. Tatsächlich hat es 2 einwertige basische Gruppen (COO-) pro Molekül, die von den 2 Carboxylgruppen abgeleitet sind, die während der Reaktion ihren Wasserstoff abgegeben haben.
3: 2-Magnesium wird dagegen als tribasisch bezeichnet, da es 3 einwertige basische Gruppen (COO-) pro Molekül aufweist, die von den 3 Carboxylgruppen abgeleitet sind, die während der Reaktion ihren Wasserstoff abgebaut haben.
Tribasisches Magnesiumcitrat ist deutlich magnesiumreicher (+ 42, 6 Gew .-%) als zweibasisches Magnesiumcitrat; Darüber hinaus ist es alkalisierender, da es drei Wasserstoffionen H + gegenüber den beiden von den zweibasigen angenommenen aufnehmen kann. In Wasser ist es jedoch weniger löslich.



