Myosin
Myosin ist der Motor der Myofibrillen; Jedes Molekül besteht aus 6 Untereinheiten, von denen 2 identische, sehr große schwere Ketten und zwei Paare kleinerer leichter Ketten sind.
Die schweren Proteinketten verflechten sich zu einem terminalen Schwanz, einer starren Spirale und zwei kugelförmigen Köpfen.
Zwei leichte Proteinketten sind mit den schweren Ketten jedes Kopfes verbunden.

Innerhalb der dicken Filamente organisieren sich die verschiedenen Isoformen des Myosins so, dass ihre Köpfe der Extremität ausgesetzt sind, während die Schwänze im zentralen Bereich über ein Bündel gruppiert sind. Die Verbindung zwischen Kopf und Schwanz ist ein flexibler Hals (Scharnier), der es den Köpfen ermöglicht, sich während der Kontraktion zu beugen.
Der kugelförmige Teil wird auch als schweres Meromiosin bezeichnet, während der terminale Teil als leichtes Meromiosin bezeichnet wird.
Die Myosin-Kugelköpfe bilden die Querbrücken, die die Wechselwirkung mit den dünnen Aktinfilamenten vermitteln, die als "Seil" fungieren.
Das Phänomen der Kontraktion kann in zwei Phasen unterteilt werden:
1) Kopplung (Bildung von Kreuzbrücken) zwischen dicken und dünnen Filamenten;
2) Filamentgleiten
Wie bereits erwähnt, hängt die Bildung von Kreuzbrücken von der Zunahme der Calciumaktivität in der Faser ab. Das Vorhandensein einer Tasche im Kopf des Myosins, die der Bindung an das ATP zugeordnet ist, sowie eines Enzyms (ATPase), das es in ADP und anorganisches Phosphat aufspalten und dabei Energie freisetzen kann, ist ebenfalls von grundlegender Bedeutung.
Actin
Actin, das die feinen Stränge des Sarkomers bildet, ist ein kugelförmiges Protein, das in seiner Form einer Kugel ähnelt (G-Actin). Viele dieser Moleküle sind miteinander verbunden, um lange und dünne Körnchen (genannt F-Actin) zu bilden. Zwei dieser Ketten wickeln sich wie zwei Perlenketten übereinander und lassen das dünne Filament entstehen.
Jedes G-Actin-Molekül enthält eine Bindungsstelle für den Myosinkopf, der im Ruhezustand tatsächlich von zwei Proteinen blockiert wird. Die dünnen Filamente bestehen in der Tat nicht nur aus Aktin, sondern auch aus:
- TROPOMIOSIN: Im ruhenden Muskel verhindert es den Kontakt zwischen 7 G-Actin-Molekülen und ihren jeweiligen Myosinköpfen und hält den Muskel entspannt.
- TROPONIN: Wenn es Kalzium bindet, ändert es seine Konformation und bewegt das Tropomyosin, was die Kopplung mit Myosin ermöglicht
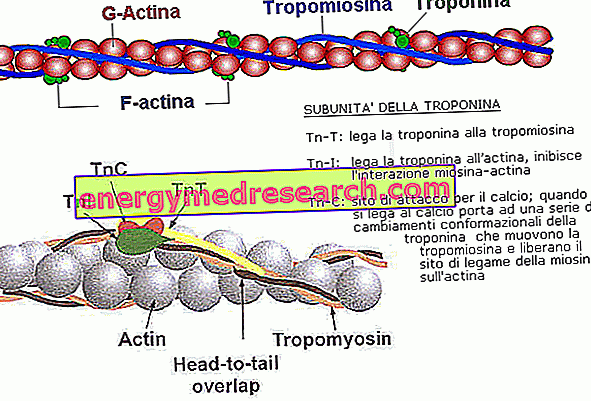
Zusätzlich zu diesen Proteinen enthalten Muskel-Myofibrillen andere, einschließlich:
Titin, Connectin und Nebulin, mit der Funktion der Stabilisierung und Zentrierung des Sarkomers während der Kontraktion.