Mit der Nahrung aufgenommene Proteine werden im Magen und Dünndarm hydrolysiert, um freie Aminosäuren und Oligopeptide zu produzieren. Diese Produkte werden von den Zellen des Dünndarms aufgenommen und in den Blutkreislauf zurückgeleitet. Die meisten Aminosäuren werden daher von den verschiedenen Organen und Geweben für Zellerneuerungsprozesse (Proteinumsatz) verwendet.
ZERSETZUNG VON AMINSÄUREN
Aminosäuren werden abgebaut:
1) für normalen Proteinumsatz
2) wenn ihre Nahrungsaufnahme zu hoch ist
3) in Mangel an Kohlenhydraten
Die erste Stufe des Aminosäurekatabolismus beinhaltet die Entfernung der Aminogruppe. Das Kohlenstoffgerüst wird somit im Krebszyklus oder bei der Glukoneogenese verwendet.
Aminotransferasen oder Transaminasen stellen die Schlüsselenzyme bei der Entfernung der Aminogruppe von Aminosäuren dar.
Transaminierungsreaktionen bestehen aus der Übertragung einer Aminogruppe von einer Donoraminosäure auf alpha-Ketoglutarat unter Bildung von Glutamat. Während dieser Reaktion wird die Donoraminogruppe in α-Ketosäure umgewandelt. Glutamat transportiert Aminogruppen zum Harnstoffzyklus oder zu den Biosynthesewegen von Aminosäuren.
Das Coenzym der Transaminasen ist Pyridoxalphosphat, ein aus Pyridoxin (Vitamin B6) hergestelltes Enzym.
Die Transaminierungen sind reversibel und können je nach den Bedürfnissen der Zelle in beide Richtungen wirken.
STICKSTOFFEXPRESSION
Üblicherweise werden die überschüssigen Aminogruppen ausgeschieden oder zur Synthese von Stickstoffverbindungen verwendet.
Ein wichtiger Prozess, dem Aminosäuren begegnen, ist die oxidative Desaminierung. Es kommt in den Mitochondrien vor und wird durch Glutamatdehydrogenase katalysiert, ein Enzym, das die Aminogruppe aus Glutamat entfernt und sie durch Sauerstoff aus dem Wasser ersetzt.
Das gebildete Ammoniumion reagiert mit Glutamat zu Glutamin, das als Transporter von Aminogruppen zur Leber fungiert. Das Enzym, das diese ATP-abhängige Reaktion ermöglicht, ist Glutaminsynthetase.
Glutamin gelangt in die Blutbahn und in die Leber, wo es in den Mitochondrien der Leber unter Freisetzung des NH4 + Ammoniumions wieder in Glutamat umgewandelt wird.
Alanin ist der Haupttransporter von Aminogruppen von den Muskeln zur Leber. Es entsteht durch Übertragung der Aminogruppe von Glutamat auf Brenztraubensäure oder Pyruvat. Ähnlich wie bei Glutamin setzt Alanin in den Mitochondrien der Leber seine eigenen Ammoniumionen frei, die Glutamat und Pyruvat bilden. Pyruvat wird in der Leber bei der Glukoneogenese benötigt.
Das NH4 + Ammoniumion ist giftig für die Körperzellen und insbesondere für das Gehirn. Wie wir gesehen haben, wird in extrahepatischen Fällen das Ammoniumion durch die Bindung mit Glutamat oder Pyruvat neutralisiert. In der Leber ist NH4 + in das nichttoxische Harnstoffmolekül eingebaut. Von der Leber produzierter Harnstoff wird über das Blut zur Ausscheidung über die Harnwege in die Nieren transportiert.
DER UREA-ZYKLUS
Der Harnstoffzyklus beginnt mit der Bildung von Carbamylphosphat durch das Enzym Carbamylphosphatsynthase. Während dieser Reaktion werden zwei ATP-Moleküle verbraucht.
Die nachfolgenden Reaktionen des Harnstoffzyklus sind in der Abbildung dargestellt.
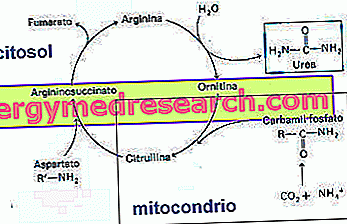
Der Harnstoffkreislauf benötigt viel Energie (4 ATP für jedes produzierte Harnstoffmolekül).
KATABOLISMUS DES KARBONISCHEN SKELETTES VON AMINSÄUREN
Das Kohlenstoffgerüst der Aminosäuren wird im Krebszyklus zur Energiegewinnung genutzt.

Wie in der Abbildung gezeigt, konvergieren die kohlenstoffhaltigen Gerüste zu sieben Verbindungen, die direkt oder indirekt in den Krebszyklus eintreten können: Pyruvat, AcetylCoA, AcetoacetylCoA, α-Ketoglutarat, SuccinylCoA, Fumarat, Oxalacetat.
Die Aminosäuren, die zu AcetylCoA oder AcetoacetylCoA abgebaut werden, werden als Ketogenetik bezeichnet und sind die Vorläufer von Ketonkörpern.
Die anderen sind glucogen und können, sobald sie in Pyruvat und Oxalacetat umgewandelt sind, durch Gluconeogenese Glucose bilden.
Siehe auch: Aminosäuren, ein Blick auf die Chemie
Protein, ein Blick auf die Chemie



