Was ist Keppra?
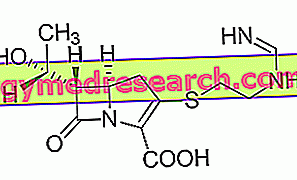
Keppra ist ein Arzneimittel, das den Wirkstoff Levetiracetam enthält. Es ist als schräge Tablette (blau: 250 mg; gelb: 500 mg; orange: 750 mg; weiß: 1000 mg), als Lösung zum Einnehmen (100 mg / ml) und als Konzentrat zur Herstellung einer Infusionslösung (Tropfeninjektion) erhältlich Tropfen in eine Vene, 100 mg / ml).
Wofür wird Keppra angewendet?
Keppra kann allein bei Patienten ab 16 Jahren mit neu diagnostizierter Epilepsie zur Behandlung von partiellen Anfällen mit oder ohne sekundäre Generalisierung angewendet werden. Es handelt sich um eine Art von Epilepsie, bei der in einem Teil des Gehirns eine übermäßige elektrische Aktivität auftritt, die Symptome wie plötzliche krampfartige Bewegungen eines Körperteils, Hörprobleme, Geruch oder Anblick, Taubheit oder plötzliches Angstgefühl hervorruft. Eine sekundäre Verallgemeinerung tritt auf, wenn sich die Hyperaktivität anschließend auf das gesamte Gehirn ausdehnt. Keppra kann auch als Adjuvans bei Patienten angewendet werden, die bereits andere Antiepileptika zur Behandlung von:
- partielle Anfälle mit oder ohne Generalisierung bei Patienten ab einem Monat;
- bei der Behandlung von myoklonischen Anfällen (kurze, ruckartige Kontraktionen eines Muskels oder einer Muskelgruppe) bei Patienten ab 12 Jahren mit juveniler myoklonischer Epilepsie;
- bei der Behandlung von generalisierten primären tonisch-klonischen Anfällen (schwere Anfälle, einschließlich Bewusstseinsverlust) bei Patienten ab 12 Jahren mit idiopathischer generalisierter Epilepsie (die Art der Epilepsie, von der angenommen wird, dass sie eine genetische Ursache hat).
Das Arzneimittel ist nur auf ärztliche Verschreibung erhältlich.
Wie wird Keppra angewendet?
In der Monotherapie sollte Keppra in einer Anfangsdosis von 250 mg zweimal täglich verabreicht werden, die nach zwei Wochen zweimal täglich auf 500 mg erhöht werden sollte. Die Dosis kann je nach Ansprechen des Patienten in Abständen von 2 Wochen bis zu einer Maximaldosis von 1 500 mg zweimal täglich weiter erhöht werden.
Wenn Keppra zu einer anderen antiepileptischen Therapie gegeben wird, beträgt die Anfangsdosis bei Patienten über 12 Jahre, die mehr als 50 kg wiegen, zweimal täglich 500 mg. Die Tagesdosis kann zweimal täglich auf 1 500 mg erhöht werden. Bei Patienten im Alter von 6 Monaten bis 17 Jahren, die weniger als 50 kg wiegen, beträgt die Anfangsdosis zweimal täglich 10 mg / kg, was erhöht werden kann
bis zu 30 mg / kg zweimal täglich. Die Lösung zum Einnehmen wird zu Beginn der Behandlung bei Kindern mit einem Gewicht von weniger als 20 kg angewendet.
Bei Säuglingen im Alter zwischen einem und sechs Monaten beträgt die Anfangsdosis zweimal täglich 7 mg / kg unter Verwendung der Lösung zum Einnehmen, die zweimal täglich auf 21 mg / kg erhöht werden kann.
Niedrigere Dosen werden bei Patienten mit Nierenproblemen (z. B. bei älteren Patienten) angewendet.
Keppra-Tabletten können unabhängig von den Mahlzeiten eingenommen und mit Flüssigkeit eingenommen werden. Die Lösung zum Einnehmen kann vor der Einnahme in einem Glas Wasser verdünnt werden. Keppra kann in der gleichen Dosis und Häufigkeit als Infusion verabreicht werden, wenn eine orale oder Tablettenverabreichung vorübergehend nicht möglich ist.
Wie arbeitet Keppra?
Der Wirkstoff in Keppra, Levetiracetam, ist ein Antiepileptikum. Epilepsie wird durch übermäßige elektrische Aktivität im Gehirn verursacht. Die genaue Wirkungsweise von Levetiracetam ist noch nicht vollständig geklärt: Es scheint jedoch ein Protein zu stören, das als synaptisches Vesikelprotein 2A bekannt ist und sich im Raum zwischen den Nerven befindet und an der Freisetzung chemischer Transmitter aus Nervenzellen beteiligt ist. Dadurch kann Keppra die elektrische Aktivität im Gehirn stabilisieren und Anfällen vorbeugen.
Welche Studien wurden mit Keppra durchgeführt?
Keppra wurde als Monotherapie bei 579 Patienten ab 16 Jahren angewendet, die Keppra oder Carbamazepin (ein anderes Antiepileptikum) für bis zu zwei Jahre erhielten. In der Studie wurde die Anzahl der Patienten angegeben, die nach Erreichen der wirksamen Dosis sechs Monate lang keine Anfälle hatten.
Keppra wurde auch als Adjuvans untersucht:
- Bei der Behandlung von partiellen Anfällen wurde es in drei Hauptstudien mit insgesamt 904 Patienten untersucht. In diesen Studien wurde Keppra 1 000 mg, 2 000 mg oder 3 000 mg pro Tag für 12 bis 14 Wochen mit einem Placebo (Scheinbehandlung) verglichen. Alle Patienten nahmen mindestens ein weiteres Antiepileptikum ein. Keppra wurde auch bei 198 Kindern im Alter von 4 bis 17 Jahren und bei 116 Kindern im Alter zwischen einem Monat und vier Jahren mit Placebo verglichen. In all diesen Studien war der Hauptindikator für die Wirksamkeit die Veränderung der Anzahl der Krisen;
- Bei myoklonischen Anfällen wurde es an 122 Patienten untersucht, denen Keppra oder ein Placebo als Zusatztherapie zum üblichen Antiepileptikum verabreicht wurde. Die Studie dauerte 30 Wochen und untersuchte die Anzahl der Anfälle vor und während der Studie, um die mögliche Reduzierung dieser Episoden zu überprüfen.
- Bei der Behandlung von generalisierten primären tonisch-klonischen Anfällen wurde Keppra bei 164 Patienten im Alter zwischen 4 und 65 Jahren mit Placebo verglichen. Die Studie untersuchte die Veränderung der Krisenrate zwischen dem Beginn der Studie und dem 20-wöchigen Zeitraum, in dem den Patienten die volle Dosis verabreicht wurde.
Welchen Nutzen hat Keppra in diesen Studien gezeigt?
In der Monotherapie und bei der Behandlung von partiellen Anfällen war Keppra bei der Vorbeugung von Anfällen genauso wirksam wie Carbamazepin. In beiden Gruppen gaben 73% der Patienten sechs Monate nach Erreichen der entsprechenden Dosis keine Anfälle an.
Als Zusatztherapie war Keppra wirksamer als Placebo:
- Bei partiellen Anfällen zeigte die Placebo-Behandlung eine Verringerung der wöchentlichen Anfallsrate von 6% bis 7%, während die Keppra-Gruppe bei einer Dosis von 1 000 mg pro Tag zwischen 18% und 18% abnahm 33%, abhängig von der Studie. Bei einer Keppra-Dosis von 2.000 mg betrug die Reduktion 27% und bei einer Keppra-Dosis von 3.000 mg 37% oder 40%. Auch bei Kindern erwies sich Keppra als wirksamer als Placebo.
- Im Fall von myoklonischen Anfällen hatten 58% der Patienten, die Keppra erhielten, eine Verringerung der Anzahl von myoklonischen Anfällen pro Woche um mindestens die Hälfte im Vergleich zu 23% der mit Placebo behandelten Patienten;
- Bei tonisch-klonischen Anfällen betrug die durchschnittliche Verringerung der Anfallsrate bei Patienten, die Placebo einnahmen, 28%, verglichen mit 57% der Patienten, die Keppra einnahmen. Die Anzahl der Kinder unter 12 Jahren war jedoch zu gering, um die Wirksamkeit der Anwendung von Keppra bei dieser Art von Krise bei Patienten dieser Altersgruppe zu unterstützen.
Welche Risiken sind mit Keppra verbunden?
Die häufigsten Nebenwirkungen von Keppra (beobachtet bei mehr als 1 von 10 Patienten) sind Schläfrigkeit und Asthenie (Schwäche) oder Müdigkeit. Die vollständige Auflistung aller mit Keppra berichteten Nebenwirkungen finden Sie in der Packungsbeilage.
Keppra darf nicht bei Patienten angewendet werden, die möglicherweise überempfindlich (allergisch) gegen Levetiracetam oder andere Pyrrolidon-Derivate (Arzneimittel mit ähnlicher Struktur) oder einen der anderen Stoffe sind.
Warum wurde Keppra zugelassen?
Der Ausschuss für Humanarzneimittel (CHMP) hat festgestellt, dass der Nutzen von Keppra allein bei der Behandlung von partiellen Anfällen mit oder ohne sekundäre Generalisierung bei neu diagnostizierten Patienten über 16 Jahren sowie bei der Therapie größer ist als das Risiko zusätzlich zur Behandlung von partiellen Anfällen bei Patienten ab einem Monat mit Epilepsie, myoklonischen Anfällen bei Patienten ab 12 Jahren mit juveniler myoklonischer Epilepsie und primären generalisierten tonisch-klonischen Anfällen bei Patienten ab 12 Jahren im Alter mit idiopathischer generalisierter Epilepsie. Der Ausschuss empfahl, die Genehmigung für das Inverkehrbringen von Keppra zu erteilen.
Weitere Informationen zu Keppra:
Am 29. September 2000 erteilte die Europäische Kommission eine Genehmigung für das Inverkehrbringen von Keppra, die in der gesamten Europäischen Union gültig ist. Die Genehmigung für das Inverkehrbringen wurde am 29. September 2005 verlängert.
Der Inhaber der Genehmigung für das Inverkehrbringen ist UCB Pharma SA.
Den vollständigen Wortlaut des EPAR für Keppra finden Sie hier.
Letzte Aktualisierung dieser Zusammenfassung: 08-2009