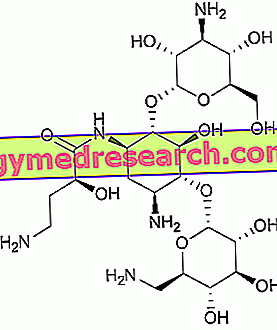
Was ist Opgenra?
Opgenra ist ein Arzneimittel, das den Wirkstoff Eptotermin alfa in zwei Durchstechflaschen enthält, wobei eine Eptotermin alfa und die andere Carmellose enthält. Die zwei Pulver werden verwendet, um eine "Suspension" (Flüssigkeit, die feste Partikel enthält) mit einer pastösen Konsistenz herzustellen, die in den Körper implantiert werden soll.
Wofür wird Opgenra angewendet?
Opgenra wird bei Erwachsenen mit Spondylolisthesis angewendet, einer Krankheit, bei der ein Lendenwirbel (einer der Knochen des unteren Teils der Wirbelsäule) nach vorne gerutscht ist und nicht mehr mit dem darunter liegenden Wirbel ausgerichtet ist. Dieser Zustand kann Schmerzen, Instabilität und Probleme aufgrund von Druck auf die Nerven verursachen, einschließlich Kribbeln, Taubheitsgefühl, Schwäche und Schwierigkeiten bei der Kontrolle einiger Muskeln. Spondylolisthesis kann chirurgisch behandelt werden, um den darüber liegenden Wirbel und den unter dem Gleitpunkt zu schmelzen (zu verbinden).
Opgenra wird ausschließlich bei Patienten angewendet, bei denen zuvor eine erfolglose autologe Transplantation (Knochentransplantation eines anderen Knochens desselben Patienten, in der Regel der Hüfte) durchgeführt wurde, oder bei Patienten, die sich dieser Operation nicht unterziehen können.
Das Arzneimittel ist nur auf ärztliche Verschreibung erhältlich.
Wie wird Opgenra angewendet?
Opgenra darf nur von einem entsprechend qualifizierten Chirurgen angewendet werden. Während der Operation trägt der Chirurg Opgenra direkt an beiden Seiten der beiden Wirbel auf, um die Knochenneubildung zu fördern und die Fusion der Wirbel zu ermöglichen.
Wie arbeitet Opgenra?
Der Wirkstoff in Opgenra, Eptotermin alfa, wirkt auf den Knochen. Es ist eine Replik des osteogenen Proteins 1, auch als Bone Morphogenic Protein 7 (BMP-7) bezeichnet, ein körpereigenes Protein, das zur Bildung von neuem Knochengewebe beiträgt. Nach der Implantation stimuliert Heptotermin alfa die Bildung von neuem Knochen und hilft dabei, die beiden Wirbel bei Patienten, die mit einer Spondylolisthesie operiert werden, zu verschmelzen.
Eptotermin alfa wird mit der sogenannten "rekombinanten DNA-Technologie" hergestellt, dh durch Insertion eines Gens (DNA) in die Zellen, die so in der Lage sind, Eptotermin alfa herzustellen. Substituierendes Eptotermin alfa wirkt auf die gleiche Weise wie natürlich hergestelltes BMP-7.
Eptotermin alfa ist seit Mai 2001 von der Europäischen Union (EU) für das Arzneimittel Osigraft zugelassen, mit dem Tibia-Frakturen repariert werden.
Wie wurde Opgenra untersucht?
Die Wirkungen von Opgenra wurden zunächst in Versuchsmodellen getestet, bevor sie an Menschen untersucht wurden. Das Unternehmen verwendete auch einige der damals verwendeten Daten, um die Genehmigung von Osigraft zu erhalten.
Opgenra war Gegenstand einer Hauptstudie mit 336 Patienten, die sich einer Spondylolisthesisoperation unterziehen mussten. Alle Patienten konnten autolog transplantiert werden. Die Studie verglich die mit Opgenra durchgeführte Intervention mit der Intervention mit einem autologen Transplantat. Der Hauptindikator für die Wirksamkeit war die Anzahl der Patienten, deren Behandlung nach zwei Jahren erfolgreich war. Die Behandlung galt als "erfolgreich", wenn auf dem Röntgenbild Knochengewebe zwischen den beiden betroffenen Wirbeln sichtbar war und der Patient eine Verbesserung der Behinderung aufwies, ohne dass eine weitere Behandlung der Wirbelsäule erforderlich war, keine schwerwiegenden Nebenwirkungen auftraten und keine Verschlechterung der durch Druck verursachten Symptome auftrat auf die nerven.
Das Unternehmen legte auch Beweise in der wissenschaftlichen Literatur vor, die bei Patienten veröffentlicht wurde, die in den USA behandelt wurden, wo das Arzneimittel seit 2004 für die Wirbelsäulenfusion zugelassen ist.
Welchen Nutzen hat Opgenra in diesen Studien gezeigt?
In der Hauptstudie war Opgenra bei Patienten, die für diese letzte Behandlung in Frage kamen, nicht so wirksam wie eine autologe Transplantation. Nach zwei Jahren war die Behandlung mit Opgenra bei 39% der Patienten erfolgreich, verglichen mit 49% der Patienten mit autologer Transplantation.
Trotz der geringeren Wirksamkeit ergaben sich aus der Studie und der veröffentlichten Literatur ausreichende Belege für die Anwendung von Opgenra bei Patienten, bei denen das autologe Transplantat nicht erfolgreich war oder bei Patienten, die für diese Intervention nicht geeignet waren. Darüber hinaus bietet Opgenra einige Vorteile gegenüber der autologen Transplantation, darunter kürzere Operationszeiten, weniger Blutverlust und weniger Schmerzen.
Welches Risiko ist mit Opgenra verbunden?
Die häufigsten Nebenwirkungen von Opgenra (beobachtet bei 1 bis 10 von 100 Patienten) sind heterotope Ossifikation (Knochenbildung außerhalb des Fusionsbereichs) und Pseudoarthrose (Fehlen einer Wirbelsäulenfusion). Bei 1 bis 10 von 100 Patienten treten nach der Wirbelsäulenoperation Nebenwirkungen auf, darunter Infektionen nach der Operation, Dehiszenz (Wundöffnung), Nässen und Erythem (Hautrötung). Die vollständige Auflistung aller mit Opgenra berichteten Nebenwirkungen finden Sie in der Packungsbeilage.
Opgenra darf nicht bei Patienten angewendet werden, die möglicherweise überempfindlich gegen Heptotermin alfa oder einen der sonstigen Bestandteile sind. Es darf auch nicht in folgenden Gruppen verwendet werden:
- Patienten mit Autoimmunerkrankungen (Erkrankungen, die durch das körpereigene Immunsystem verursacht werden und normale Gewebe angreifen);
- Patienten mit aktiver Infektion an der operierten Stelle oder mit wiederholten Infektionen;
- Patienten mit unzureichender Hautbedeckung oder Blutversorgung am Operationsort;
- Patienten, die zuvor mit BMP-haltigen Arzneimitteln behandelt wurden;
- Patienten mit Krebs oder einer Krebsbehandlung;
- Patienten mit Knochen, die noch trainiert werden, wie Kinder und Jugendliche.
Warum wurde Opgenra zugelassen?
Der Ausschuss für Humanarzneimittel (CHMP) gelangte zu dem Schluss, dass der Nutzen von Opgenra für die posterolaterale Lendenwirbelsäulenfusion bei erwachsenen Patienten mit Spondylolisthesis im Falle eines früheren autologen Transplantatversagens oder einer Kontraindikation für eine solche Behandlung gegenüber dem Risiko überwiegt. Der Ausschuss empfahl, die Genehmigung für das Inverkehrbringen von Opgenra zu erteilen.
Welche Maßnahmen werden zur Gewährleistung der sicheren Anwendung von Opgenra ergriffen?
Das Unternehmen, das Opgenra herstellt, hat sich dazu verpflichtet, Chirurgen in verschiedenen Mitgliedstaaten ein Informationskit und eine Selbstanleitungs-DVD zur Verfügung zu stellen, einschließlich Informationen zur Sicherheit von Opgenra und einer Erinnerung an die Herstellung und Anwendung des Arzneimittels während der Operation. Das Unternehmen verpflichtete sich außerdem, dem CHMP Projekte für Langzeitstudien vorzulegen, in denen die Sicherheit und Wirksamkeit des Arzneimittels sowie die Art und Weise, in der es unter realen Bedingungen angewendet wird, bewertet werden.
Weitere Informationen zu Opgenra:
Am 19. Februar 2009 erteilte die Europäische Kommission dem Unternehmen Howmedica International S. de RL eine Genehmigung für das Inverkehrbringen von Opgenra, die in der gesamten Europäischen Union gültig ist.
Für den vollständigen Wortlaut des EPAR von Opgenra klicken Sie hier.
Letzte Aktualisierung dieser Zusammenfassung: 11-2008.