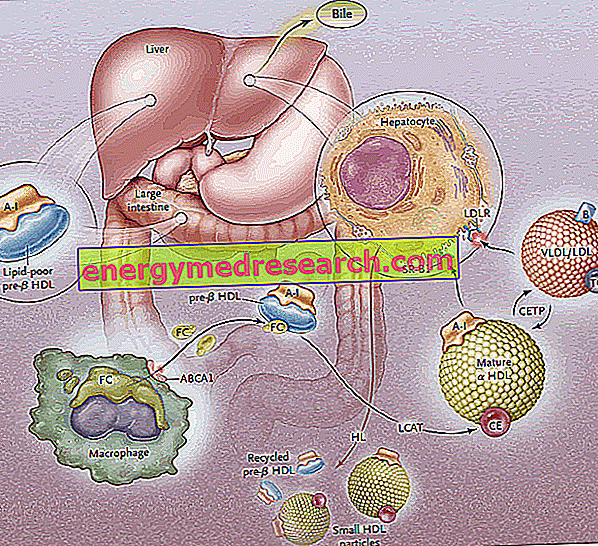
Der umgekehrte Cholesterintransport (RCT) ist der Prozess, bei dem Cholesterin aus peripheren Geweben entfernt wird, indem es in HDL-Lipoproteine eingebaut und anschließend zur biliären Ausscheidung in die Leber transportiert wird.
Periphere Zellen können, wie alle nicht-intestinalen oder hepatischen Zellen, überschüssiges Cholesterin nicht abbauen. Für die Aufrechterhaltung der zellulären Homöostase ist daher das Vorhandensein eines Mechanismus zur Entfernung von Cholesterin aus den Zellen von wesentlicher Bedeutung. Dieser Mechanismus, der auf die hepatische Rückgewinnung von überschüssigem peripherem Cholesterin abzielt, wird als "umgekehrter Cholesterintransport" (RCT: reverse cholesterol transport ) bezeichnet.
Lassen Sie uns den Prozess im Detail untersuchen.
Die Biosynthese von HDL-Lipoproteinen durchläuft die Synthese und die anfängliche Sekretion der Hauptproteinkomponenten (Apoproteine), gefolgt von der extrazellulären Aufnahme von Lipiden (Phospholipiden und Cholesterin), wodurch reife HDL-Partikel gebildet werden.
Die erste Stufe des umgekehrten Cholesterintransports besteht in der Produktion von scheibenförmigen Vorläufern von HDL durch den Darm und die Leber, die auf ihrer Oberfläche Apoproteine (hauptsächlich ApoA-I) freisetzen; Auf diese Weise werden Vorläufermoleküle von HDL freigesetzt, die als Pre-B-HDL bezeichnet werden und sehr geringe Mengen an Cholesterin und Lipiden, insbesondere Phospholipiden, enthalten. Das Vorhandensein dieser Vorläufermoleküle auf peripherer Ebene fördert den Transfer von überschüssigem freiem Cholesterin (FC) - das aus peripheren Gewebezellen entweicht - zu Apo AI durch die Intervention eines Membrantransporters namens ATP-Bindungskassette A1 (ABCA1) ). Dieser Transporter befindet sich auf der Zelloberfläche und in den Golgi-Membranen und kann die Lipide vom Golgi-Apparat zur Zellmembran transportieren, wodurch ihr Ausfluss erleichtert wird. Sobald das freie Cholesterin in die nativen HDLs gelangt, greift ein plasmatisches Enzym hepatischen Ursprungs ein, das als Plasma-Lecithin-Cholesterin-Acyltransferase oder einfacher als LCAT bezeichnet wird. Dieses Enzym wandelt das in das Prä-B-HDL eingebaute freie Cholesterin in Cholesterinester um und wandelt das Prä-B-HDL in seine reife α-HDL-Form um. In der Praxis wandelt die kontinuierliche Akkumulation von Cholesterin im Lipoproteinkern das scheibenförmige HDL in kugelförmige und pralle Partikel um, die weiterhin Apoproteine aus den triglyceridreichen Lipoproteinpartikeln aufnehmen und miteinander verschmelzen können. Während des gesamten Prozesses spielt das Apolipoprotein AI eine Schlüsselrolle und stimuliert sowohl die Aktivität des ABCA1-Transporters als auch die des LCAT. Da ApoAI das am weitesten verbreitete Apolipoprotein in HDL ist, hängt seine Plasmakonzentration direkt mit dem HDL-Cholesterinspiegel zusammen.
BITTE BEACHTEN SIE: Der Veresterungsprozess ist von grundlegender Bedeutung, um die Umverteilung von Cholesterin von HDL auf die Plasmamembran zu verhindern. dieser Mechanismus nutzt die in den Phosphatidylcholinmolekülen vorhandene Fettsäure in Position zwei aus.
Der LCAT-vermittelte Veresterungsprozess transformiert dann die Prä-B-HDL-Moleküle in ihre "reife" kugelförmige α-HDL-Form. Diese Lipoproteine werden dann auf zwei verschiedenen Wegen in die Leber transportiert, wo sie Cholesterin freisetzen.
In einem ersten Fall liefert HDL, das reich an verestertem Cholesterin ist, dieses Lipid an Lipoproteine, die reich an Triglyceriden sind (Lipoproteine mit sehr niedriger Dichte und niedriger Dichte), und wird dann von der Leber über spezifische Rezeptoren (LDL-R) abgefangen und aus dem Kreislauf entfernt. Ziel ist es, das periphere Cholesterin über das LDL-Rezeptorsystem in die Leber zu transportieren und dann das HDL vom überschüssigen Cholesterin auf die periphere Ebene zu "entladen", um es wieder verfügbar zu machen, um es aus dem Gewebe zu erhalten. HDLs, die sich selbst von Cholesterin befreien, akzeptieren Triglyceride im Austausch und dies geschieht dank des Cholesterinester-Transfer-Proteins (CETP). Die Aufgabe dieses Proteins ist es daher, die Umverteilung und das Gleichgewicht von Cholesterinestern und Triglyceriden zwischen den Lipoproteinen HDL, LDL, IDL, VLDL, Chylomicron und Chylomicron zu fördern, was letztendlich zu einer Anreicherung von führt HDL-Triglyceride zum Nachteil von Cholesterinestern und zur Verringerung der HDL-Größe.
Der zweite Weg beinhaltet hepatische SR-B1-Rezeptoren für HDL, die reich an verestertem Cholesterin sind, in Abwesenheit eines gleichzeitigen Abbaus des Proteinanteils von HDL, der dann recycelt wird. In der Praxis können Sie mit diesem Enzym die HDLs aus ihrem Inhalt entfernen und neue Pre-B-HDLs regenerieren. Ein Teil des HDL und des ApoA-I wird jedoch auf lysosomaler Ebene sowohl in der Leber- als auch in der Nierenzelle internalisiert und abgebaut. Die durch SR-B1 vermittelte Aufnahme wird durch die Aktivität der Leberlipase effizienter, die in der Lage ist, das HDL durch Hydrolyse der Oberflächenphospholipide umzugestalten und den Fluss von verestertem Cholesterin vom Lipoproteinkern zur Plasmamembran zuzulassen (es wird angenommen, dass zwischen dem zum anderen ist ApoE auch an der selektiven Aufnahme beteiligt, da Mäuse, denen das ApoE-Gen fehlt, eine verminderte Wirksamkeit dieses Signalwegs aufweisen. SR-BI wird hauptsächlich in der Leber, den Nebennieren und dem Eierstock exprimiert.