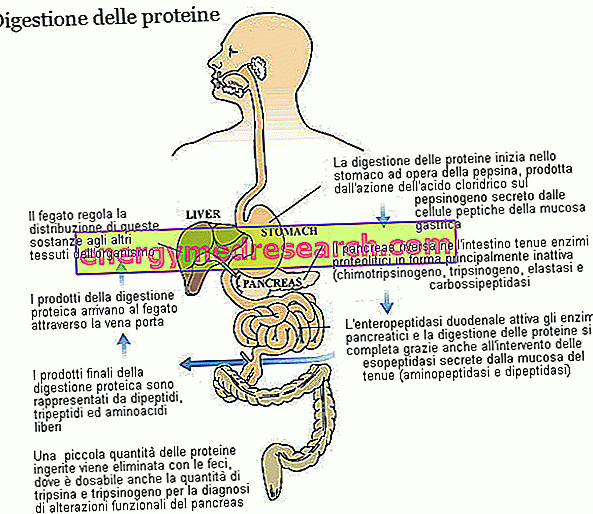
Trypsin und Chymotrypsin sind zwei Schlüsselenzyme bei der Verdauung von Nahrungsproteinen. Beide werden als Zymogene, dh in inaktiver Form, von der Bauchspeicheldrüse produziert und ausgeschieden; Der Zymogenvorläufer von Trypsin wird Trypsinogen genannt, während der von Chymotrypsin Chymotrypsinogen genannt wird.
Trypsin und Chymotrypsin gehören zur großen Familie der proteolytischen Enzyme (die an der Proteinverdauung beteiligt sind) und zur Endopeptidase-Untergruppe. Diese Substanzen - einschließlich Magen-Pepsin und Pankreas-Elastase - greifen Peptidbindungen innerhalb der Aminosäurekette an und führen zu kleineren Molekülfragmenten. Die Enzyme der zweiten Gruppe, der Exopeptidasen, vervollständigen die Arbeit von Trypsin und Chymotrypsin und lösen einzelne Aminosäuren von den Enden der Peptidkette. Zu dieser Familie gehören Pankreas-Carboxypeptidasen (A1, A2 und B, die das Carboxylende angreifen), aber auch Aminopeptidasen (die das Aminoterminalende angreifen) und Dipeptidasen, die beide von der Schleimhaut des Dünndarms produziert und ausgeschieden werden. Einige Carboxypeptidasen, die denen für Trypsin (Trypsinogen) und Chymotrypsin (Chymotrypsinogen) ähneln, werden in inaktiver Form von der Bauchspeicheldrüse ausgeschieden. In allen drei Fällen ist das am enzymatischen Aktivierungsprozess beteiligte Enzym die Enteropeptidase, ein Protein, das von den Zellen der Zwölffingerdarmschleimhaut produziert und ausgeschieden wird. Insbesondere ist die Enteropeptidase spezifisch für Trypsinogen, das, sobald es in Trypsin umgewandelt wurde, auch die anderen proteolytischen Enzyme, einschließlich Trypsinogen selbst, aktiviert.
Die funktionellen Unterschiede zwischen Trypsin und Chymotrypsin betreffen lediglich deren Spezifität, dh die Fähigkeit, nur die durch genau definierte Aminosäuren gebildeten Bindungen zu erkennen und aufzulösen. Trypsin greift hauptsächlich in die Peptidbindungen ein, an denen basische Aminosäuren (wie Arginin und Lysin) beteiligt sind, während Chymotrypsin hauptsächlich Bindungen hydrolysiert, an denen Tyrosin, Phenylalanin, Tryptophan, Leucin und Methionin beteiligt sind.
Dank der verschiedenen proteolytischen Enzyme werden Nahrungsproteine, die ursprünglich aus mehreren zehn Aminosäuren bestehen, unter Einbeziehung der Magensäure in Dipeptide, Tripeptide und freie Aminosäuren zerlegt, allesamt leicht resorbierbare Substanzen, die aus den Kapillaren der Darmschleimhaut stammen in die Leber transportiert.
Trypsin und Chymotrypsin im Stuhl
Die Bestimmung von Chymotrypsin und Trypsin in Fäkalien wird und wurde insbesondere in der Vergangenheit als indirekter Test der Funktionsfähigkeit der exokrinen Bauchspeicheldrüse verwendet. Wenn etwas auf dieser Drüsenebene nicht richtig funktioniert, ist es logisch, eine verringerte Synthese von Trypsin und Chymotrypsin zu erwarten, die auch im Stuhl mangelhaft sein wird. Der Test hat eine gute Empfindlichkeit, ist jedoch mit dem realen Risiko von falsch-positiven und falsch-negativen Ergebnissen belastet. Die Verwendung von Abführmitteln verringert beispielsweise die Konzentration von Enzymen im Kotmaterial, während die Aufnahme von Verdauungsextrakten aus der Bauchspeicheldrüse (wie Pankreatin) oder Gemüse (z. B. Ananasstiel, Papaya, Papain und Bromelain) falsch negative Ergebnisse verursachen. Auch die Darmbakterienflora beeinflusst geringfügig die Menge an Trypsin und Chymotrypsin, die unverändert im Kot ankommen. Aus diesem Grund kann der Einsatz von Antibiotika zu falschen Negativen führen. Im Gegenteil, bei Vorhandensein von Divertikulose und anderen Bedingungen, die die bakterielle Proliferation begünstigen, können falsch positive Ergebnisse aufgezeichnet werden.
Eine klassische Anwendung der Trypsin- und Chymotrypsindosis im Stuhl ist der Nachweis von Pankreasinsuffizienz bei Patienten mit Mukoviszidose. Eine der Folgen dieser Krankheit ist die Beeinträchtigung des normalen Transports von Trypsin und anderen Verdauungsenzymen von der Bauchspeicheldrüse zum Zwölffingerdarm; Aus diesem Grund sind die Fäkalien des Kindes mit Mukoviszidose bei der Geburt besonders kompakt und verursachen eine Darmobstruktion. Dadurch werden besonders geringe Mengen an Chymotrypsin und Trypsin in Mekonium aufgenommen.