Morphologie
Auf makroskopischer Ebene kann bei der Alzheimer-Krankheit ein variabler Grad an kortikaler Atrophie (Abnahme des Gewebes oder der Organmasse) beobachtet werden, der durch eine Vergrößerung der Parietalfurchen gekennzeichnet ist, die in den Frontal-, Temporal- und Parietallappen stärker akzentuiert ist. Diese Atrophie wird durch eine Vergrößerung der Kammerhöhlen infolge des Verlusts des Parenchyms ausgeglichen (Abbildung 1). Insbesondere in den fortgeschrittenen Stadien der Krankheit verkümmern die Strukturen des medialen Temporallappens, einschließlich des Hippocampus, der entorhinalen Kortikalis und der Amygdala, aufgrund ihrer Beteiligung ab den frühen Stadien der Pathologie stark.
Darüber hinaus weist die Alzheimer-Krankheit auch mikroskopische Veränderungen auf, die als extrazelluläre senile Plaques und intrazelluläre neurofibrilläre Cluster bekannt sind und die Grundlage für die histologische Diagnose bilden. Mit dem Fortschreiten der Krankheit kommt es dann zu einem schwerwiegenden neuronalen Verlust, der von einer Gliose (umschriebene oder diffuse Proliferation von Neurogliazellen, dh Zellen, die das unterstützende Stroma des Nervengewebes bilden) in denselben Regionen begleitet wird wo das Vorhandensein von neurofibrillären Plaques und Clustern größer ist.
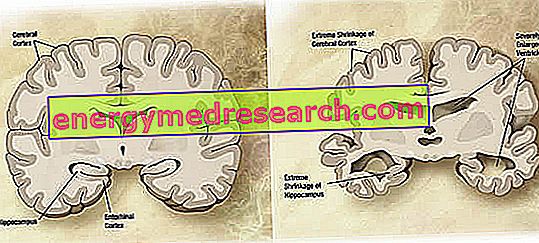
Abbildung 1. Koronalschnitt des Gehirns: Unterschiede zwischen normalem Gehirn und von AD betroffenem Gehirn (Wikipedia-Bildquelle).
Pathogenese
Die Alzheimer-Krankheit ist hauptsächlich durch zwei typische Läsionen gekennzeichnet: Die extrazelluläre Akkumulation seniler Plaques, die hauptsächlich aus dem β-Amyloid-Peptid (Aβ) und intraneuronalen neurofibrillären Clustern besteht, die durch hyperphosphoryliertes Tau-Protein gebildet werden.
- Senile Plaques können auf der Ebene von Gehirnregionen wie Hippocampus, Amygdala und Neocortex gefunden werden.
Das Aβ-Peptid stammt von einem proteolytischen Schnitt des Amyloid-Protein-Vorläufers (APP) durch β-Sekretase. Dieser Schnitt erzeugt ein terminales Carboxyfragment mit 99 Resten (CTF oder C99), das anschließend von der β-Sekretase geschnitten wird, um Aβ-Fragmente mit unterschiedlichen Längen zu erzeugen. Es ist bekannt, dass die am häufigsten vorkommende Aβ-Spezies das Aβ40-Fragment ist. Ein anderes bekanntes Fragment, das aus dem proteolytischen Schnitt gebildet wird und weniger häufig als Aβ40 vorkommt, ist Aβ42, das eher zur Bildung von Amyloidfibrillen neigt, die sich als Aβ-Spezies im Gehirn eines Menschen mit Alzheimer-Krankheit ansammeln.
- Eine weitere Komponente der Alzheimer-Krankheit sind neurofibrilläre Cluster, die aus im Zytoplasma von Neuronen vorhandenen Filamentbündeln bestehen. Neurofibrilläre Cluster sind unlöslich und scheinen in vivo resistent gegen Proteolyseprozesse zu sein, sodass sie in Gewebeschnitten auch noch lange nach dem neuronalen Tod vorhanden bleiben. Unter Beobachtung der Struktur bestehen die Fibrillencluster aus Doppelhelixfilamenten und linearen Filamenten ähnlicher Zusammensetzung. Bei der Analyse der Zusammensetzung bestehen die Doppelhelixstränge hauptsächlich aus hyperphosphoryliertem Tau-Protein. Tau ist ein axonales Protein, das mit Mikrotubuli assoziiert ist und dessen Zusammenbau erleichtert.
Andere wichtige neuropathologische Veränderungen bei der Alzheimer-Krankheit sind mitochondriale Dysfunktion, oxidative neuronale Schädigung, synaptischer Verlust und axonale Degeneration.
Neurochemische Aspekte
Wie bereits erläutert, stellt das aus dem proteolytischen Schnitt des APP-Vorläufers stammende Aβ-Peptid eine neurotoxische Komponente der Alzheimer-Krankheit dar . Insbesondere wurde die Hypothese aufgestellt, dass Aβ für normale Gehirnfunktionen wichtig sein und, wenn es bestimmte Konzentrationen übersteigt, neurotoxisch werden kann. Darüber hinaus könnten sowohl die Aggregate als auch die verschiedenen Isoformen von Aβ eine unterschiedliche biologische, physiologische oder pathologische Rolle spielen und die nachfolgenden Stadien der Krankheit bestimmen und daran teilnehmen. Es wurde beobachtet, dass Aβ als Neuromodulator wirkt und die Freisetzung einiger Neurotransmitter ohne offensichtliche Anzeichen von Neurotoxizität beeinflusst.
Beispielsweise könnte die neuromodulatorische Rolle von Aβ im physiologischen Kontext eine wichtige Bedeutung für das richtige Gleichgewicht des Neurotransmittersystems haben. Es ist bekannt, dass dieses System aus Neurotransmittern besteht, Substanzen, die durch synaptische Übertragung Informationen zwischen den Zellen des Nervensystems, den Neuronen, übertragen.
Andererseits könnte die Aβ-vermittelte synaptische Übertragung unter pathologischen Bedingungen mit einer Veränderung der Neurotransmission vor neurodegenerativen Ereignissen zusammenhängen. Infolge dieser Veränderungen können frühkognitive und nichtkognitive Störungen auftreten, die auf den betroffenen Neurotransmittersystemen und den verschiedenen beteiligten Gehirnbereichen beruhen.
Die Veränderungen der Neurotransmittersysteme und des Signalübertragungsmechanismus im Gehirn von Menschen mit Alzheimer-Krankheit sind sehr komplex. Eines der offenbar veränderten Systeme betrifft das cholinerge Signalsystem, an dem der Neurotransmitter Acetylcholin beteiligt ist. In der Tat wurde gezeigt, dass Personen, die an Alzheimer leiden, eine verringerte cholinerge Übertragung auf der Ebene von Kortex und Hippocampus aufweisen, einem wichtigen Bereich des Gehirns, der Phänomenen wie Lernen und Gedächtnis gewidmet ist. Zusätzlich zu diesem Neurotransmittersystem wurden Veränderungen des noradrenergen, serotonergen sowie des Glutamat- und GABA-Systems bei der Alzheimer-Krankheit beobachtet.



