Von Dr. Rita Fabbri
Gegenanzeigen, besondere Warnhinweise und geeignete Vorsichtsmaßnahmen für die Anwendung, unerwünschte Wirkungen
Aloe Vera Gel kann sicher in topischen Anwendungen eingesetzt werden: Die Palette dieser auf dem Markt erhältlichen Produkte ist wirklich riesig. In Bezug auf Aloe-Vera-Saft liegen derzeit keine genauen Daten zur optimalen Tagesdosis vor. Es wird jedoch empfohlen, nicht mehr als 250 ml / Tag einzunehmen (38).
Für die topische Anwendung sind keine bekannten Kontraindikationen, keine Warnhinweise und keine berichteten Nebenwirkungen erforderlich. Obwohl selten, wurden Fälle von allergischen Reaktionen gemeldet.
Es wurde auch gezeigt, dass Aloe-Vera-Gel die Heilung tiefer vertikaler chirurgischer Wunden verzögert, wie sie beispielsweise bei der Kaiserschnitt-Entbindung entstehen (39).
Zur systemischen Anwendung siehe Anhang unten.
Pharmakologische Hinweise zu Anthrachinonen
Anthrachinone sind Substanzen, die die Darmperistaltik stimulieren und daher abführend wirken.
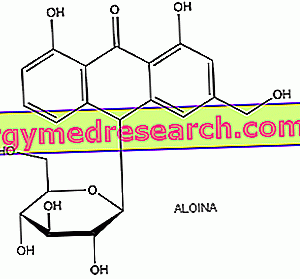
Anthrachinone haben eine allgemeine chemische Struktur, die durch drei kondensierte Benzolringe und durch Substituenten gekennzeichnet ist, die im Allgemeinen die Positionen 9 und 10 einnehmen, da sie besonders reaktiv sind. Anthrachinone liegen normalerweise in Form von Glycosiden vor, chemischen Verbindungen, die aus einem zuckerhaltigen Teil (Glycoon genannt) und einem nicht zuckerhaltigen Teil (Aglycon genannt) bestehen. In Anthrachinonglycosiden gehören Aglycone zur Klasse der Anthracenderivate; Barbaloin ist beispielsweise ein C-Glykosid, das aus Aloe-Emodin-Antron gewonnen wird. Die glykosidische Form ermöglicht es diesen Verbindungen, unverändert durch den Magen und den Dünndarm bis in den Dickdarm zu gelangen, wo sie von der Bakterienmikroflora in die jeweiligen Aglykone, die eigentlichen aktiven Metaboliten, umgewandelt werden, die die abführende Wirkung lokal auf zwei Arten ausüben : Ansammlung von Flüssigkeit im Darmlumen und Veränderung der Darmmotilität; Danach binden sie sich, ohne absorbiert zu werden, an den Darminhalt und werden mit dem Kot ausgestoßen.
Das Fehlen oder die verminderte Aufnahme von Anthracenglykosiden durch den Körper sowie die Abwesenheit von Veränderungen in Richtung Darmschleimhaut machen diese Produkte sicher und frei von unerwünschten Wirkungen, vorausgesetzt, einige Kontraindikationen werden eingehalten und dies ist sehr wichtig Sie werden in den empfohlenen Dosen angewendet und nur im Ernstfall verabreicht.
Stimulierende Abführmittel sind bei der kurzfristigen Behandlung von gelegentlicher Verstopfung angezeigt. Bei chronischer Verstopfung stellen dagegen die Veränderung der Ernährungsgewohnheiten, der körperlichen Aktivität und der intestinalen Umerziehung die beste Lösung dar (40-41).
Die Verwendung von Abführmitteln sollte über einen längeren Zeitraum vermieden werden, und es ist ratsam, einen Arzt zu konsultieren, wenn sie länger als zwei Wochen eingenommen werden.
Bei wiederholt auftretenden Verstopfungsepisoden ist es ratsam, die Ursachen der Störung zu untersuchen.
Verstopfung ist nicht immer mit Darmatonie verbunden, manchmal kann sie durch Hyperkinesie oder Dyskinesie verursacht werden, wie im Fall des Reizdarmsyndroms. Sehr oft wird Verstopfung durch nervöse Faktoren, Angstzustände oder Stress verschlimmert. In all diesen Fällen werden die Anthrachinone nicht empfohlen.
Alle stimulierenden Abführmittel sind bei Schwangerschaft (42-44) und Stillen (45) - geringe Mengen von Metaboliten gehen in die Muttermilch über - bei Kindern unter 10 Jahren und bei akuten entzündlichen Darmerkrankungen kontraindiziert (Colitis ulcerosa, Enterokolitis, Blinddarmentzündung, Morbus Crohn), bei Bauchschmerzen unbekannter Ursache, bei Darmverschluss und Stenose sowie bei schweren Dehydrationszuständen mit Flüssigkeits- und Elektrolytmangel (46).
Wie alle Abführmittel sollten Anthrachinone nicht bei nicht diagnostizierten, akuten oder anhaltenden Abdomensymptomen verabreicht werden.
Hohe Dosen von Anthrachinon-Abführmitteln führen zu einer fast vollständigen Entleerung des Dickdarms, und der natürliche Mangel an Stimulation am nächsten Tag (oder sogar zwei Tage danach) kann die Patienten dazu zwingen, das Abführmittel wiederzuverwenden, wobei möglicherweise die Dosierung erhöht wird. Auf diese Weise entsteht eine psychologische Abhängigkeit, diktiert durch die Angst des Subjekts, Verzögerungen zwischen einer Evakuierung und der folgenden zu regulieren.
Der Missbrauch von Anthrachinon-Abführmitteln kann Störungen des Wasser- und Elektrolythaushalts verursachen, insbesondere Hypokaliämie, Dickdarmschwäche und Verschlimmerung der Verstopfung.
Hypokaliämie verstärkt die Wirkung von Herzglykosiden und interagiert mit Antiarrhythmika. Die Kombination mit anderen Arzneimitteln, die eine Hypokaliämie auslösen (z. B. Thiazindiuretika, Corticosteroide), kann das Elektrolyt-Ungleichgewicht verstärken (47). Der Elektrolytspiegel, insbesondere der Kaliumspiegel, muss immer überwacht werden, insbesondere bei älteren und jungen Menschen.
Die dunkle Pigmentierung der Kolonschleimhaut, definiert als Pseudomelanosis coli, die nach chronischer Einnahme von Anthrachinon-Abführmitteln (aber auch von anderen Abführmitteln) beobachtet wird, ist nicht schädlich und mit der Behandlungssuspension reversibel.
Auch die gelbbraune oder rotviolette Farbe des Urins (pH-abhängig) aufgrund der Wirkung von Anthrachinonmetaboliten ist klinisch nicht signifikant (48-49).
Unterleibskrämpfe und Schmerzen können manchmal auftreten, insbesondere bei Patienten mit einem gereizten Dickdarm. Eine kürzlich durchgeführte Beobachtungsstudie zeigt, dass eine kolonspezifische Formulierung, die Anthrachinone aus Senna angustifolia in Mischung mit mikroverkapselten Ölen von Mentha piperita und Matricaria camomilla enthält, Verstopfung entgegenwirken kann, ohne erkennbare entzündliche Zustände zu bestimmen, die durch Schmerzen, Krämpfe und Blähungen gekennzeichnet sind Bauch-, Meteorismus-, Blähungs- und Durchfallzustände (50).
Bibliographie
- Kanter, MM, Freie Radikale und Bewegung: Auswirkungen der Nahrungsergänzung mit Antioxidantien. Exerc. Sport Sci. Rev., 23: 375, 1995.
- Kanter, MM, et al., Auswirkungen eines Antioxidans-Vitamin-Gemisches auf die Lipidperoxidation in Ruhe und nach dem Training. 74: 965, 1993.
- Yamaguchi et al., Bestandteile des Gels von Aloe Vera. Biowissenschaftliche Biotechnologie und Biochemie. 57-8.1350-1352.
- Saben-Farideh (1993) Studien zum Status von antioxidativen Enzymen und Metaboliten bei Verbrennungen und zum Vorhandensein von antioxidativen Enzymen in der Aloe-Vera-Pflanze (Tumor-Nekrose-Faktor, Glutathion), S. 138.
- Davis, Didonato, Hartman (1994). Entzündungshemmende und wundheilende Wirkung einer Wachstumssubstanz in Aloe Vera.
- PubMed Januar 1989. Davis, Maro.
- Lushbaugh CC und Hale DB: Experimentelle akute Radiodermatitis nach Betastrahlung. V. Histopathologische Untersuchung der Wirkungsweise der Therapie mit Aloe Vera. Cancer 6, 690 & ndash; 698, 1953.
- Vorteilhafte Wirkungen von Aloe bei der Wundheilung JP Heggers, Pelley RP, Robson MC Phytotherapy Research, Band 7, S48-S52 (1993). Universitätsklinik für Chirurgie und Graduiertenschule für Biomedizinische Wissenschaften, Medizinische Abteilung der Universität von Texas, Galveston, USA.
- Davis RH, Leitner MG und Russo JM: Aloe Vera, ein natürlicher Ansatz zur Behandlung von Wunden, Ödemen und Schmerzen bei Diabetes. J Am Pod Med Assoc 78, 60-68, 1988.
- Ajabnoor MA: Wirkung von a loes auf den Blutzuckerspiegel bei normalen und alloxandiabetischen Mäusen. J. Ethnopharmacol 28, 215-220, 1990
- El Zawahry M, Hegazy MR und Helal M: Verwendung von Aloe bei der Behandlung von Ulcus cruris und Dermatosen . Int. J. Dermatol. 12, 68-73, 1973.
- Management von Psoriasis mit Aloe-Vera-Extrakt in einer hydrophilen Creme: eine placebokontrollierte Doppelblindstudie Trop Med Int Health 1996 Aug; 1 (4): 505-9 Syed TA; Ahmad SA; Holt AH; Ahmad SA, Ahmad SH; Afzal M Abteilung für klinische Physiologie, Universitätsklinikum Malmö, Schweden.
- Medizinischer Grunddienst. Institut für soziale Sicherheit. Abgeordneter von San Marino. Januar 2000 Andriani, Bugli, Alders, Castelli et al.
- Grindlay D und Reynolds T: Das Aloe-Vera-Blatt-Phänomen: Ein Überblick über die Eigenschaften und die moderne Verwendung des Blattparenchym-Gels. J Ethnopharmacol 16, 117 & ndash; 151, 1986.
- Shelton RW: Aloe Vera, seine chemischen und therapeutischen Eigenschaften . Int. J Dermatol 30, 679 & ndash; 683, 1991.
- Kahlon JB et al.: In-vitro-Bewertung der synergistischen antiviralen Wirkung von Acemannan in Kombination mit Azidothymidin und Acyclorir. Mol Biother 3, 214-223, 1991.
- Anonym: Aloe Vera kann den AZT steigern. Med Tribune, 22. August 1991, S. 4.
- Pulse TL und Uhlig E: Eine signifikante Verbesserung in einer klinischen Pilotstudie unter Verwendung von Nahrungsergänzungsmitteln, essentiellen Fettsäuren und stabilisiertem Aloe-Vera-Saft bei 29 seropositiven, ARC- und AIDS-Patienten. J Adv Med 3, 209 & ndash ; 230, 1990.
- Sänger J: Eine randomisierte, placebokontrollierte Studie mit oralem Acemannan als Ergänzung zur antiretroviralen Therapie bei fortgeschrittener HIV-Erkrankung. Int Conf AIDS 9 (1), 494, 1993. [Abstract Nr. PO-B28-2153]
- Blätter MA, et al.: Studien zur Wirkung von Acemannan auf Retrovirus-Infektionen: Klinische Stabilisierung von Katzen, die mit dem Leukämievirus infiziert sind. Mol Biother 3, 41 & ndash ; 45, 1991.
- Hart LA, et al.: Auswirkungen von niedermolekularen Bestandteilen aus Aloe Vera Gel auf den oxidativen Metabolismus und die zytotoxischen und bakteriziden Aktivitäten menschlicher Neutrophilen . Int J Immunol Pharmacol 12, 427 & ndash; 434, 1990.
- Womble D und Helderman JH: Verbesserung der gesamten Nachhaltigkeit menschlicher Lymphozyten durch Acemannan (CarrisynTM). Int J Immunopharmacol 10, 967 & ndash; 974, 1988.
- Peng SY, et al .: Verringerte Mortalität des Norman-Maus-Sarkoms bei Mäusen, die mit dem Immunmodulator Acemannan behandelt wurden. Mol Biother 3, 79 & ndash ; 87, 1991.
- Harris C, et al .: Wirksamkeit von Acemannan bei der Behandlung von spontanen Neubildungen bei Hunden und Katzen. Mol Biother 3, 207 & ndash ; 213, 1991.
- Krebsforschungslabors der UdSSR. 1986. Gribel, Pashinskii.
- Fujita K, Ito S, Teradaira R, Beppu H, Eigenschaften der Carboxypeptidase von Aloe, Biochem. Pharmacol., 28: 1261 & ndash; 1262, 1979.
- Fujita K, Teradaira R, Nagatsu T: Bradykininaseaktivität von Aloeextrakt, Biochem. Pharmacol., 25: 205, 1976.
- Davis RH, et al.: Entzündungshemmende Wirkung von Aloe Vera gegen ein Spektrum von Reizstoffen. J Am Pod Med Assoc 79, 263 & ndash; 266, 1989.
- Davis RH, et al .: Die Isolierung eines aktiven Hemmsystems aus einem Extrakt aus Aloe Vera. J. Am. Pod. Med. Assoc. 1991, Mai; 81 (5): 258-61.
- Saito H, Reinigung von Wirkstoffen der Aloe a. und ihre biologische und pharmakologische Aktivität, Phytother. Res., 7: S14-S1, 1993.
- Davis RH et al .: Aloe Vera, Hydrocortison und Sterol beeinflussen die Wundzugfestigkeit und Entzündungshemmung. J Am Pod Med Assoc 1994 Dec; 84 (12): 614 & ndash; 21.
- Davis RH, et al.: Topische Wirkung von Aloe mit Ribonukleinsäure und Vitamin C auf die adjuvante Arthritis. J Am Pod Med Assoc 75, 229 & ndash ; 237, 1985.
- Bland J: Wirkung von oral konsumiertem Aloe-Vera-Saft auf die Magen-Darm-Funktion des Menschen. Natural Foods Network Newslett, August 1985.
- Blitz JJ, Smith JW und Gerard JR: Aloe Vera Gel in der Ulkustherapie: Vorläufiger Bericht. J Am Osteopathol Soc 62, 731 & ndash; 735, 1963.
- Yamaguchi I, Mega N, Sanada H: Bestandteile des Gels von Aloe Vera Burm-f, Biosci. Biotech. Biochem., 57 (8): 1350 & ndash; 1352, 1993.
- Shida T et al .: Wirkung von Aloeextrakt auf die periphere Phagozytose bei Asthma bronchiale bei Erwachsenen. Planta Medica 51, 273 & ndash ; 275, 1985.
- Godding EW: Therapeutika von Abführmitteln unter besonderer Berücksichtigung von Anthrachinonen. Pharmacology 14 (Suppl 1), 78 & ndash; 101, 1976.
- Stärken und Grenzen der Aloe Vera. Rowan Hamilton American Journal of Natural Medicine, Band 5, Nr. 10; 30-33, Dezember 1998.
- Schmidt JM und Greenspoon JS: Aloe Vera Hautwundgel ist mit einer Verzögerung der Wundheilung verbunden. Obstet Gynecol 78, 115-117, 1991.
- Steinegger E, Hansel R. Aloe. In: Pharmakognosie, 5. Aufl. Berlin Springer, 1992: 428 & ndash; 31.
- Müller-Lissner S. Nebenwirkungen von Abführmitteln: Fakt und Fiktion. Pharmacology 1993.47 (Suppl1): 138 & ndash; 45.
- Westendorf J. Anthranoid-Derivate - Aloe-Arten. In: De Smet PAGM, Keller K., Hansel R., Chandler RF, Redaktion. Nebenwirkungen von pflanzlichen Arzneimitteln, Band 2. Berlin: Springer, 1993: 119-23.
- Bangel E, Pospisil M, Rötz R, Falk W. Tierexperimentelle pharmakologische Untersuchungen zur Frage der abortiven und teratogenen Wirkung sowie zur Hyperamie von Aloe. Steiner-Informationsdienst 1975; 4: 1-25.
- Schmidt L. Vergleichende Pharmakologie und Toxikologie der Laxantien. Arch Exper Path Phamakol 1995; 226: 207-18.
- Faber P, Strenge-Hesse A. Offenbarung der Rheinausscheidung in die Muttermilch. Pharmacology 1988; 36 (Suppl 1): 212 & ndash; 20.
- Reynolds JEF, Herausgeber. Martindale - Die Extra-Phama-Copoeia. 31. Aufl. London: Royal Pharmaceutical Society, 1996: 1202-3, 1240-1.
- Brunton LL. Wirkstoffe, die den gastrointestinalen Wasserfluss und die Motilität, Erbrechen und Antiemetika beeinflussen; Gallensäuren und Pankreasenzyme In: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Gilman AG, Herausgeber. Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9. Ausgabe. New York: McGrew-Hill, 1996: 917 & ndash; 36.
- Deutsch FJ. Abführmittel bei Verstopfung. Am J Gastroenterol 1985; 80: 303 & ndash; 9.
- Ewe K, Karbach U. Tatsächlicher Durchfall. Clin Gastroenterol 1986; 15: 723 & ndash; 40.
- Di Pierro F, Rapacioli G., Callegari A., Attolico M., Ivaldi L., Candidi C. Klinische Wirksamkeit bei Verstopfung einer Zubereitung auf der Basis von Anthrachinonen und ätherischen Ölen: Begleitende abführende Wirkung mit entzündungshemmender Wirkung. Der Gastroenterologe ; Jahr XXXI, Nr. 1-2 / 2009.



