Was sind sie
Liposomen sind geschlossene vesikuläre Strukturen, die von 20 bis 25 nm bis zu 2, 5 μm (oder 2500 nm) reichen können. Ihre Struktur (die der von Zellmembranen sehr ähnlich ist) ist durch das Vorhandensein einer oder mehrerer Doppelschichten von amphiphilen Lipiden gekennzeichnet, die einen hydrophilen Kern begrenzen, in dem sich Material in wässriger Phase befindet. Weiterhin liegt die wässrige Phase auch außerhalb der Liposomen vor.
Das Interesse an dieser Entdeckung war sofort groß, insbesondere im medizinisch-pharmazeutischen Bereich. Es ist nicht überraschend, dass Liposomen seit den 1970er Jahren in experimenteller Form als Arzneimittelträger verwendet wurden. Nach und nach haben die Forscher gelernt, die Eigenschaften von Liposomen zu perfektionieren, um sie in die Lage zu versetzen, die gewünschte therapeutische Wirkung zu entfalten.
Die Forschung auf diesem Gebiet war und ist sehr intensiv, so dass es nicht verwunderlich ist, dass Liposomen derzeit als wirksame Drug-Delivery-Systeme eingesetzt werden.
Struktur
Struktur und Eigenschaften von Liposomen
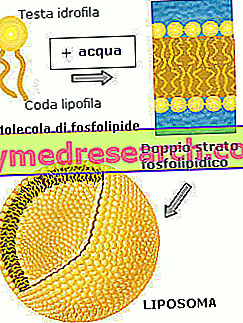
Wie erwähnt, weisen Liposomen eine Struktur auf, die durch das Vorhandensein einer oder mehrerer Doppelschichten von amphiphilen Lipiden gekennzeichnet ist. Im Detail werden diese Doppelschichten meist von Phospholipidmolekülen gebildet: Diejenigen der äußersten Schicht werden regelmäßig nebeneinander angeordnet und setzen ihren polaren Kopf (hydrophiler Teil des Moleküls) der sie umgebenden wässrigen Umgebung aus; Der apolare Schwanz (hydrophober Teil des Moleküls) ist stattdessen nach innen gewandt, wo er mit dem der zweiten Lipidschicht verflochten ist, die eine Organisation hat, die die vorherige widerspiegelt. Tatsächlich sind in der inneren Phospholipidschicht die Polköpfe der wässrigen Umgebung zugewandt, die in der Liposomenhöhle enthalten ist.
Dank dieser besonderen Struktur können die Liposomen in einer wässrigen Phase eingetaucht bleiben und gleichzeitig einen wässrigen Inhalt enthalten, in dem Wirkstoffe oder andere Moleküle dispergiert werden können.
Gleichzeitig wird - dank der doppelten Phospholipidschicht - der Eintritt und Austritt von Wassermolekülen oder polaren Molekülen verhindert, wodurch der Inhalt des Liposoms (der durch Eintritt oder Austritt nicht verändert werden kann) wirksam isoliert wird. von Wasser oder polaren gelösten Stoffen).

Niosomen
Niosomen ( nicht ionische Liposomen ) sind spezielle Liposomen, deren Struktur sich von den "klassischen" Liposomen unterscheidet. Tatsächlich werden in Niosomen die Phospholipidschichten durch nichtionische amphiphile Syntheselipide ersetzt, die üblicherweise zu Cholesterin hinzugefügt werden. Die Niosomen sind kleiner als 200 Nanometer, sie sind sehr stabil und weisen verschiedene besondere Eigenschaften auf, die sie unter anderem für die topische Anwendung sehr gut geeignet machen.
Features
Die Eigenschaften von Liposomen hängen von der typischen Struktur ab, mit der diese Vesikel ausgestattet sind. Tatsächlich besitzen die Außenschichten eine bemerkenswerte Affinität zu den Plasmamembranen, deren Zusammensetzung sie in groben Zügen darstellen (natürliche Phospholipide wie Phosphatidylcholin, Phosphatidylethanolamin und Cholesterinester).
Auf diese Weise können die in den liposomalen Mikrosphären enthaltenen wasserlöslichen Substanzen leicht in die Zellen transportiert werden.
Gleichzeitig kann das Liposom auch pharmakologisch aktive lipophile Moleküle in seine äußere Phospholipiddoppelschicht einbauen.
Darüber hinaus können, wie erwähnt, die Eigenschaften von Liposomen verbessert werden, um die Vesikel den unterschiedlichsten Anforderungen anzupassen. Zu diesem Zweck ist es erforderlich, je nach dem zu erreichenden Ziel strukturelle Änderungen verschiedener Art vorzunehmen: Beispielsweise kann das Problem der Instabilität von Phospholipiden (hohe Oxidationsneigung) durch partielle Hydrierung und Zugabe gelöst werden von einem Antioxidans (Alpha-Tocopherol) oder durch Rückgriff auf Lyophilisation (Proliposomen), wodurch die Stabilität der Vesikel für sehr lange Zeit erhalten werden kann.
Weiterhin kann die Lipiddoppelschicht so aufgebaut sein, dass sie die Bindung an bestimmte Zelltypen erhöht, beispielsweise durch Antikörper, Lipide oder Kohlenhydrate. In gleicher Weise kann die Affinität der Liposomen zu einem bestimmten Gewebe durch Variation der Zusammensetzung und der elektrischen Ladung verändert werden (durch Zugabe von positiv geladenen Stearylamin- oder Phosphatidylserinvesikeln werden negative Ladungen erhalten, während mit Dicetylphosphat negative Ladungen erhalten werden) die Konzentration des Arzneimittels im Zielorgan.
Schließlich ist es zur Erhöhung der Halbwertszeit von Liposomen möglich, die Oberfläche zu modifizieren, indem Polyethylenglykolmoleküle (PEG) an die Lipiddoppelschicht konjugiert werden, wodurch sogenannte " Stealth-Liposomen " entstehen. Eine von der FDA zugelassene Krebsbehandlung verwendet PEG-beschichtete Liposomen, die Doxorubicin transportieren. Wie oben erwähnt, erhöht diese Beschichtung die Halbwertszeit von Liposomen, die sich allmählich in Krebszellen konzentrieren, die die Kapillaren des Tumors durchdringen. Diese sind in der Tat neueren Datums und sind durchlässiger als die von gesundem Gewebe und ermöglichen als solche, dass sich die Liposomen im neoplastischen Gewebe ansammeln und hier die für die Krebszellen toxischen Wirkstoffe freisetzen.
Anwendungen
Verwendung und Anwendung von Liposomen
Aufgrund ihrer besonderen Eigenschaften und Strukturen werden Liposomen in verschiedenen Bereichen eingesetzt: vom medizinischen und pharmazeutischen Bereich bis zum rein kosmetischen Bereich. Da die Liposomen eine hohe Affinität zum Stratum Corneum aufweisen, werden sie in diesem Bereich intensiv eingesetzt, um die Hautresorption von funktionellen Substanzen zu begünstigen.
Im medizinischen und pharmazeutischen Bereich finden Liposomen hingegen sowohl im therapeutischen als auch im diagnostischen Bereich Anwendung.
Insbesondere die Fähigkeit von Liposomen, ihren Inhalt von der äußeren Umgebung zu isolieren, ist besonders nützlich bei der Beförderung von Substanzen, die zum Abbau neigen (wie zum Beispiel Proteine und Nukleinsäuren).
Gleichzeitig können Liposomen genutzt werden, um die Toxizität einiger Arzneimittel zu verringern. Dies ist beispielsweise bei Doxorubicin der Fall, einem Krebsmedikament, das bei Eierstock- und Prostatakrebs angezeigt ist und in Liposomen mit langer Zirkulation eingeschlossen ist Die Pharmakokinetik wurde erheblich verändert und der Grad der Wirksamkeit und Toxizität wurde verbessert.
Einstufung
Klassifikation und Arten von Liposomen
Die Klassifizierung von Liposomen kann nach verschiedenen Kriterien durchgeführt werden, wie z. B .: Abmessungen, Struktur (Anzahl der Doppellipidschichten, aus denen das Liposom besteht) und angewandte Herstellungsmethode (diese letzte Klassifizierung wird jedoch in der vorliegenden Beschreibung nicht berücksichtigt Artikelkurs).
Diese Klassifikationen und die Haupttypen von Liposomen werden nachstehend kurz beschrieben.
Einteilung nach baulichen und maßlichen Kriterien
Abhängig von der Struktur und Anzahl der Phospholipid-Doppelschichten, mit denen jedes Vesikel ausgestattet ist, können die Liposomen unterteilt werden in:
Unilamellare Liposomen
Unilamellare Liposomen bestehen aus einer einzelnen Phospholipiddoppelschicht, die einen hydrophilen Kern einschließt .
Abhängig von ihrer Größe können unilamellare Liposomen weiter eingeteilt werden in:
- Kleine unilamellare Vesikel oder SUVs ( Small Unilamellar Vesicles ), deren Durchmesser von 20 nm bis 100 nm variieren kann;
- Große unilamellare Vesikel oder LUV ( Large Unilamellar Vesicles ), deren Durchmesser von 100 nm bis zu 1 μm variieren kann;
- Riesige unilamellare Vesikel oder GUV ( Giants Unilamellar Vesicles ), deren Durchmesser größer als 1 μm ist.
Multilamellare Liposomen
Die multilamellaren Liposomen oder MLV ( MultiLamellar Vesicles ) sind komplexer, da sie durch das konzentrische Vorhandensein verschiedener Lipidschichten (im Allgemeinen mehr als fünf) gekennzeichnet sind, die durch wässrige Phasen voneinander getrennt sind (Zwiebelhautstruktur). Für dieses spezielle Merkmal erreichen multilamellare Liposomen Durchmesser im Bereich von 500 bis 10.000 nm. Mit dieser Technik ist es möglich, eine höhere Anzahl von lipophilen und hydrophilen Wirkstoffen einzukapseln.
Zur Gruppe der multilamellaren Liposomen gehören auch die sogenannten Oligolamellen- oder OLV- Liposomen ( OligoLamellar Vesicles ), die immer aus einer Reihe konzentrischer doppelter Phospholipidschichten bestehen, aber im Vergleich zu den "richtigen" multilamellaren Liposomen eine geringere Anzahl aufweisen.
Multivescicular Liposomen
Die multiveskulären Liposomen oder MVV ( MultiVesicular Vesicles ) zeichnen sich durch das Vorhandensein einer doppelten Phospholipidschicht aus, in der andere Liposomen eingeschlossen sind, die jedoch nicht konzentrisch sind wie bei multilamellaren Liposomen.
Andere Klassifikationen
Zusätzlich zu dem, was bisher gesehen wurde, ist es möglich, ein anderes Klassifizierungssystem anzuwenden, das Liposomen unterteilt in:
- PH-sensitive Liposomen : Sie sind Vesikel, die ihren Inhalt in leicht saurer Umgebung freisetzen. Tatsächlich protonieren die Lipide, aus denen sie bestehen, bei einem pH-Wert von 6, 5 und begünstigen die Freisetzung des Arzneimittels. Diese Eigenschaft ist nützlich, weil sehr oft auf der Ebene der Tumormassen aufgrund des nekrotischen Gewebes, das sich mit dem Wachstum des Tumors bildet, eine signifikante Absenkung des pH-Wertes auftritt.
- Temperaturempfindliche Liposomen : Sie setzen ihren Inhalt bei einer kritischen Temperatur frei (im Allgemeinen bei 38-39 ° C). Zu diesem Zweck wird nach der Verabreichung der Liposomen der Bereich, in dem sich die Tumormasse befindet, beispielsweise durch Ultraschall erwärmt.
- Immunoliposomen : Sie setzen ihren Inhalt frei, wenn sie mit einer Zelle in Kontakt kommen, die ein bestimmtes Antigen enthält.
Vor- und Nachteile
Hauptvorteile und -nachteile von Liposomen
Die Verwendung von Liposomen hat eine Reihe von erheblichen Vorteilen, wie zum Beispiel:
- Die Bestandteile der äußeren Phospholipidschichten sind biokompatibel, verursachen also keine unerwünschten toxischen oder allergischen Wirkungen;
- Ich kann sowohl hydrophile als auch lipophile Moleküle in das Zielgewebe einbauen.
- Die geförderten Substanzen sind durch die Einwirkung von Enzymen (Proteasen, Nukleasen) oder durch denaturierende Umgebungen (pH) geschützt;
- Sie sind in der Lage, die Toxizität von toxischen oder reizenden Stoffen zu verringern;
- Sie können auf verschiedenen Wegen (oral, parenteral, topisch usw.) verabreicht werden.
- Sie können so synthetisiert werden, dass ihre Affinität für bestimmte Zielorte (Proteine, Gewebe, Zellen usw.) erhöht wird.
- Sie sind biologisch abbaubar, frei von Toxizität und können derzeit in großem Maßstab hergestellt werden.