Was ist Insulin?
Insulin ist ein Hormon der Proteinnatur, das von Gruppen von Pankreaszellen produziert wird, die als "β-Zellen der Langerhans-Inseln" bezeichnet werden. Es wurde 1921 vom Engländer John James Macleod und 1923 vom kanadischen Nobelpreis für Medizin Frederick Grant Bating entdeckt.
Funktionen
Insulin ist das anabole Hormon schlechthin, und zwar durch seine Wirkung:
- Erleichtert den Durchgang von Glukose aus dem Blut zu den Zellen und hat daher eine hypoglykämische Wirkung (senkt den Blutzucker). Fördert die Akkumulation von Glucose in Form von Glykogen (Glykogenosynthese) in der Leber und hemmt den Abbau von Glykogen zu Glucose (Glykogenolyse).
- Es erleichtert den Durchgang von Aminosäuren aus dem Blut zu den Zellen, hat eine anabole Funktion, da es die Proteinsynthese stimuliert und die Neoglukogenese (Glukosebildung ab einigen Aminosäuren) hemmt.
- Es erleichtert den Durchtritt von Fettsäuren aus dem Blut in die Zellen, regt die Fettsäuresynthese aus Glucose und überschüssigen Aminosäuren an und hemmt die Lipolyse (energetische Nutzung von Fettsäuren).
- Erleichtert die Passage von Kalium in die Zellen.
- Stimuliert die Zellproliferation.
- Es stimuliert die Verwendung von Glukose zur Energieerzeugung.
- Es stimuliert die endogene Produktion von Cholesterin.
Der größte Anreiz für die Insulinwirkung ist eine Mahlzeit, die reich an einfachen Kohlenhydraten und wenig Ballaststoffen, Fett und Eiweiß ist. Auch einige Medikamente (Sulfonylharnstoffe) können ihre Sekretion steigern.
Insights
Insulin und SportInsulin und DopingGlykämie und AbnehmenDiabetesInsulinresistenz-Hyperinsulinämie Schnelles Insulin und langsames Insulin Auf Insulin basierende MedikamenteZusammenfassung
Proinsulin ist der biosynthetische Vorläufer von Insulin. Es gibt auch ein Prä-Pro-Insulin, das im Vergleich zu Proinsulin eine Aminosäuresequenz besitzt, die als Signal für seinen Transport dient, zuerst im Retikuloendoplasma und dann im Golgi, wo es die richtige Konformation erreicht.
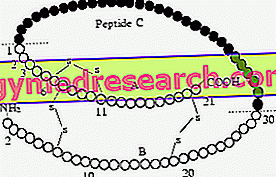
Insulin wird als ein für Polyribosomen einzigartiges Protein der globulären Polypeptidkette freigesetzt. anschließend wird das Hormon in Form eines Granulats abgelagert, das eine unter dem Elektronenmikroskop sichtbare kristalline Form erreicht. Mit zunehmender Konzentration wird das Insulin in Dimere (ein Paar von Monomeren, die durch schwache Bindungen zusammengehalten werden) und Dimere oder Hexamertrimer (zusammengehalten durch 2 zentrale Zaco-Ionen, die mit den 3 Tyrosinen der Dimere und den drei Molekülen von H2O exakoordiniert sind) aggregiert ).
Nachdem das Insulin in den Kreislauf abgegeben wurde, gelangt es durch Verdünnung in die dimere und monomere Form, die vom Insulinrezeptor erkannt wird.
Einige Forscher stellten fest, dass es im Humaninsulin variable Regionen gibt, insbesondere die Aminosäuresequenzen Nr. 28 und 29 (Pro-Lys) der β-Kette; Anschließend wurde festgestellt, dass die Umkehrung dieses AA-Insulins direkt in den monometrischen Zustand überging und den dimeren übersprang. So wurde das "Lys Pro" oder "Rapid Insulin" geboren, ein Medikament, das besonders nützlich ist, wenn es in der Nähe einer großen Mahlzeit injiziert wird.
Aktionsmechanismus
Der Insulinrezeptor ist ein Transmembranglykoprotein, das aus 4 Ketten (2α außerhalb der Zelle und 2β innerhalb der Zelle) besteht, die durch Sulfidbrücken miteinander verbunden sind. Das Molekül hat eine eher kurze Halbwertszeit und unterliegt daher einem schnellen Umsatz. Auch es wird als Vorstufe vom rauen endoplasmatischen Retikulum synthetisiert und dann im Golgi verarbeitet. Die 2 & agr; -Ketten sind reich an Cysteinen, während die & bgr; reich an hydrophobem AA sind, das sie an der Zellmembran verankert, und Thyroxin, das dem inneren Teil des Cytosols zugewandt ist.
Die Bindung von Insulinrezeptoren stimuliert die Tyrosinkinaseaktivität und führt zu der Ausgabe von 1 ATP für phosphoryliertes Tyrosin. Dies führt zu einer Reihe von Kettenereignissen (Aktivierung der G-Phospholipase C-Proteine), die zur Bildung von zwei Produkten führen: der DAG, die an der Membran verankert bleibt und in die Phosphorylierung von Proteinen eingreift, und der IP3, die auf zytosolischer Ebene wirkt Ca ++ - Ionenfreisetzung.
Wenn der Blutzuckerspiegel ansteigt, erhöht sich die Insulinmenge, die von Pankreaszellen ausgeschüttet wird. In insulinabhängigen Zellen wirkt die Insulinrezeptorbindung auf einen intrazellulären Pool von Vesikeln und setzt den Glucosetransporter frei, der durch Fusion auf die Membran übertragen wird. Der Transport von Glukose in die Zelle führt zu einer Abnahme des Blutzuckers, was wiederum die Dissoziation zwischen Insulin und seinem Rezeptor stimuliert. Diese Dissoziation löst einen ähnlichen Prozess der Endozytose aus, bei dem der Träger in die Vesikel zurückgebracht wird.
Diabetes und Insulin
Der Begriff Diabetes kommt aus dem Griechischen und bedeutet Diabetes durchzugehen . Eines der charakteristischen klinischen Anzeichen dieser Pathologie ist das Vorhandensein von Zucker im Urin, der über die Niere gelangt, wenn seine Konzentration im Blut einen bestimmten Wert überschreitet. Dieser Begriff wurde mit dem Adjektiv Mellitus in Verbindung gebracht, weil der Urin aufgrund des Vorhandenseins von Zucker süß ist und der Geschmack früher die einzige Möglichkeit war, die Krankheit zu diagnostizieren
Diabetes mellitus ist eine chronische Krankheit, die durch Hyperglykämie gekennzeichnet ist, dh durch eine Erhöhung des Zuckergehalts (Glukose) im Blut. Es wird durch eine verminderte Sekretion von INSULIN oder durch die Kombination von verminderter Sekretion und peripherem Widerstand gegen die Wirkung dieses Hormons verursacht.
Unter normalen Bedingungen gelangt von der Bauchspeicheldrüse freigesetztes Insulin in den Blutkreislauf, wo es als "Schlüssel" fungiert, der benötigt wird, um Glukose in die Zellen zu bringen, die es je nach metabolischem Bedarf verwenden oder als Reserve deponieren. Dies erklärt, warum ein Mangel oder eine veränderte Insulinwirkung mit einer Erhöhung des Zuckergehalts einhergeht, einer für Diabetes typischen Eigenschaft.